資料來源與版權所有:每日頭條
來了!C肝第四代抗病毒藥物!
文章來源:康安途海外就醫 2017-06-26
歐洲藥品管理局(EMA)人用藥物委員會 (CHMP) 同日建議歐盟批准兩種用於成人C肝治療的新藥 Maviret 和Vosevi。
一.目前,國內的患者可以選擇的C肝口服新藥有:
1.治療病毒基因型1a藥物:兩種
Harvoni夏奉寧、Viekirax維建樂+Exviera易奇瑞。
2.治療病毒基因型1b藥物:三種
Harvoni夏奉寧、Daklinza坦克干+Sunvepra速威干、
Viekirax維建樂+Exviera易奇瑞。
3.治療病毒基因型2a藥物:一種
Sovaldi索華迪+Ribavirin雷巴威林。
4.治療全部6種病毒基因型藥物吉利德三代(Epclusa),雖然尚未核准進口,但也可自行向食藥署申請學名藥的進口。當然,夏奉寧(Harvoni)、索華迪(Sovaldi)亦同。
5.治療病毒基因型1a、1b型及第4型藥物的賀肝樂(Zepatier),預計八月加入健保給付。
二.Maviret和Vosevi
Maviret(AbbVie公司)為兩種藥物組成的組合製劑,每日一次,一次三片,含有NS3 / 4A蛋白酶抑制劑 glecaprevir(100mg)和 NS5A 抑制劑 pibrentasvir(40mg)。
Vosevi(Gilead公司)是一種含有三種藥物的組合製劑,每日一次,一次一片,分別為核苷酸類似物非結構蛋白NS5B聚合酶抑制劑 sofosbuvir(400 mg),HCV NS5A抑制劑 velpatasvir(100 mg)和新型泛基因型HCV NS3 / 4A蛋白酶抑制劑 voxilaprevir(100mg)。
EMA在一份新聞稿中說:「Maviret和Vosevi都對所有基因型的病毒都有活性,而且兩種藥物之間存在一些差異,可能對某些治療失敗或不能使用以前的治療藥物治療的患者特別有用。」
「由於這被認為在治療創新方面具有重大的公共衛生利益,因此根據歐盟的加速評估機制對這兩種藥物進行了評估,旨在加快患者獲得未滿足醫療需求的新藥的使用。」他們指出。
功效和安全數據
Maviret 的療效是在超過2300名患者參與的8項關鍵和三項支持性臨床試驗中證明的。
AbbVie 在一篇新聞稿中指出,在一項分析中,Maviret治療8周使807/828例(97.5%)未經治慢性HCV感染的無肝硬化患者獲得持續病毒學應答(SVR12)。在2265例患者的綜合分析中,不到0.4%的患者出現停藥。這些試驗中觀察到 Maviret 的副作用一般是輕度的,包括頭痛,疲勞,腹瀉,噁心和腹痛。
「如果獲得批准,Maviret 對無肝硬化的患者以及絕大多數基因型(GT1-6)C肝患者來說將是一個每日一次,不含利巴韋林,療程僅為8周的治療選擇。」 AbbVie在新聞稿中表示。
Vosevi 的臨床療效是在涉及1700多例患者的4項主要臨床試驗中研究證實的。在未經治療的患者中進行了兩項試驗,另外2項在以前的治療(在某些情況下與NS5A抑制劑)中沒有清除病毒的患者中進行。
在經治患者中給予 Vosevi 12周治療,在未經治的患者中給予8周治療。 EMA表示,治療結束後90%以上患者獲得SVR12。
「在申請中的數據支持 Vosevi 用於有或沒有代償期肝硬化、所有基因型(GT1-6)C肝患者、不管曾接受治療與否患者的治療,包含未曾使用DAA治療的無肝硬化患者療程僅為8周,使用以前DAA治療方案失敗的患者則為12周療程。」Gilead 在新聞稿中補充說。
觀察到使用 Vosevi 後出現最常見的副作用為輕度噁心,頭痛和腹瀉。其他可能相關的副作用是食慾下降,嘔吐,肌肉痙攣和皮疹。
有關使用 Maviret 和 Vosevi 的詳細使用建議將在產品說明書中提供,將在歐洲公共評估報告中公布,並將在歐盟委員會批准營銷授權後提供歐盟所有官方語言。
-------------------
資料來源與版權所有:壹讀
最新C肝抗病毒藥物治癒率高達97%,劍指吉三代!
由 丙友之家 發表于 健康 2017-06-28
C肝是一種傳染性極強、危害性很高的病毒性肝炎,我國約有3000萬例C肝病毒攜帶者,若不及時接受治療,C肝會發展至肝硬化甚至肝癌,由於肝硬化是不可逆轉的,無異於宣告患者提早踏上了「死亡班車」!
吉三代(伊柯鲁沙Epclusa)
但自從2013年12月6日,吉一代在美國上市的那一刻,C肝病毒便迎來了它的「天敵」-直接抗病毒藥物(DAAs)。2014年,吉二代(索菲布韋 +雷迪帕韋)的治癒率高達95%;而2016年6月28日,美國FDA正式批准吉利德伊柯魯沙(吉三代,Epclusa)在美國上市,它對C肝病毒的清除率更是高達99%,幾乎宣告了C肝病毒的「死刑」!
不過,近日歐洲藥品管理局(EMA)人用藥物委員會 (CHMP) )建議批准兩種泛基因型C肝新藥(Maviret 和Vosevi)用於治療成人慢性C型肝炎(HCV)感染。據悉,Maviret治療後的12周持續病毒學應答已經達到了97.5%,完全具有了挑戰吉三代的資格!下面為大家詳細介紹下官方公布的實驗數據和藥物信息:
Maviret和Vosevi 的相關數據
1、 EMA公告:aviret和Vosevi對所有基因型病毒均具有活性,而且兩種藥物之間存在一些差異,可能對某些治療失敗或不能使用既往可用藥物治療的患者有所助益。
2、 Maviret的一項實驗中,828名初次接受治療的C肝患者有807名患者達到了SVR12,治癒率97.5%;
3、 Maviret的一項實驗中,2265名C肝患者中僅有0.4%的患者停藥,副作用較輕微;
4、 Vosevi的臨床實驗中,經治患者給予Vosevi 12周治療,未經治患者中給予Vosevi 8周治療。治療結束後,90%以上的患者獲得SVR12;
5、 藥物上市許可申請中的數據支持Vosevi用於所有基因型(GT1-6)、代償期或非代償期肝硬化C肝患者。
通過上述部分實驗數據,Maviret和Vosevi 的療效是大家有目共睹的。歐洲藥品管理局也指出:」鑒於該藥物在治療嚴重的或危及生命的疾病方面具有重大的公共衛生利益,因此歐盟對這兩種藥物進行了優先評估,保障在最短時間內為患者提供新的治療選擇。」
不過,雖然Maviret和Vosevi 的療效甚優,但和吉三代比起來還是有一定差距的,因為吉三代對於未經治療的C肝患者的治癒率超過99%!而在研究中觀察到服用Vosevi後最常見的不良事件為輕度噁心、頭痛和腹瀉。
或許Maviret和Vosevi 目前還無法撼動吉三代的地位,但我們可以看到Maviret和Vosevi 還是有自己打的優勢的。不管怎樣,從C肝患者的角度來看,多一份療效不錯的C肝新藥,就是多一份生命的希望!
----------------------------
資料來源與版權所有:壹讀
三管齊下,吉利德科學公司全新C肝雞尾酒藥物有望在歐洲上市
文章來源:國際肝病 2017-06-26
C肝是一種傳染性極強、危害性很高的病毒性肝炎,在彼岸約有3000萬例C肝病毒帶原者,台灣有75萬人感染C肝,若不及時接受治療,C肝會發展至肝硬化甚至肝癌,由於肝硬化是不可逆轉的,無異於宣告患者提早踏上了「死亡班車」!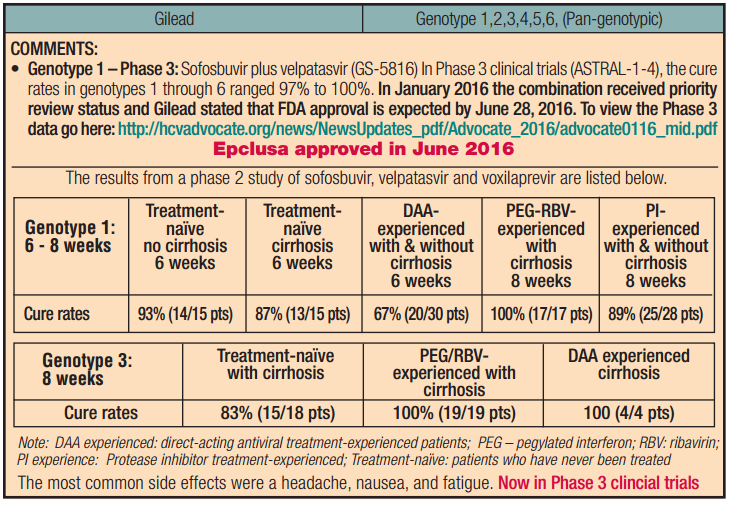
2017年6月22日。歐洲藥品管理局(EMA)人用醫療產品委員會(CHMP)對Vosevi®的上市許可申請(marketing authorization application,MAA)給出了支持意見。目前,EMA正在對該藥進行加速審評,決定其是否能在歐盟28個國家和挪威、冰島上市。Vosevi®是吉利德科學公司推出的第四種基於Sofosbuvir的抗HCV藥物,為薄膜包衣片劑,含有索非布韋(Sofosbuvir)400mg+維帕他韋(Velpatasvir)100mg和voxilaprevir(100 mg)三種活性成分(SOF/VEL/VOX)。三種成分分別針對了HCV生命周期中的三個重要靶點:SOF為HCV NS5B聚合酶抑制劑,VEL為NS5A抑制劑,VOX為NS3/4A蛋白酶抑制劑。
該藥適用於治療成人慢性HCV感染,包括初治和經治、1~6型基因型、無肝硬化或代償期肝硬化患者。
根據臨床試驗,其應用方案可為:DAA初治的無肝硬化患者療程為8周,既往接受直接抗病毒藥物(DAA)方案治療失敗的患者治療12周。
吉利德科學公司提出的Vosevi®上市申請的支持數據來自4項III期臨床試驗(POLARIS研究系列)。
→POLARIS-1和POLARIS-4研究 針對既往DAA治療失敗的基因1~6型C型肝炎患者。患者接受SOF/VEL/VOX每日一片治療12周。兩項研究共納入445例患者,97%(431例)達到了主要療效終點(SVR12)。
→POLARIS-2和POLARIS-3研究 針對DAA初治的基因1~6型C型肝炎患者。患者接受SOF/VEL/VOX每日一片治療8周。
POLARIS-2研究中,501例基因1~6型、無肝硬化或有代償期肝硬化的患者經治療後,95%(477例)達到了主要療效終點(SVR12)。
POLARIS-3研究中,110例伴有肝硬化的基因3型C型肝炎患者經治療後96%(106例)達到了主要療效終點(SVR12)。
安全性方面,POLARIS研究系列中接受SOF/VEL/VOX治療的患者最常見的不良事件是頭痛、疲乏、腹瀉和噁心。
另外,2016年12月,吉利德科學公司也向美國FDA提出了Vosevi的上市申請。這不僅將是一個適用於全基因型HCV感染的高效藥物,也將是DAA經治失敗人群的有效解決方案。
Gilead在美國提交了SOF / VEL / VOX的監管申請。吉利德於2016年12月8日提交了SOF / VEL / VOX新藥申請。美國專利商標局已經給出了VOSEVI商標序列號87219959。
部分資料引用自胡敏雄的肝病筆記,特此致謝!
- Jul 01 Sat 2017 15:55
來了!C肝第四代抗病毒藥物!
全站熱搜
 留言列表
留言列表
發表留言


 留言列表
留言列表
 人電強身功
人電強身功 